| Головна » 8 клас » Хімія |
Цілі уроку: закріпити знання учнів про хімічні властивості основ; розвивати вміння й навички проведення хімічного експерименту, складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ. Тип уроку: формування вмінь і навичок, урок-дослідження. Форми роботи: лабораторна робота, робота з опорною схемою. Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, хімічні реактиви, плакат «Правила техніки безпеки в кабінеті хімії».
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашнього завдання, актуалізація опорних знань 1. BaO+H2O→Ba(OH)2 2. CO2+H2O→ H2CO3 3, 4. Ba(OH)2+H2CO3→BaCO3+ 2H2O Робота з опорною схемою «Хімічні властивості основ»
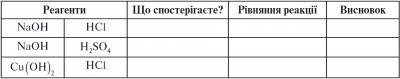
ІІІ. Формування навичок і вмінь Лабораторна робота № 4. Взаємодія розчинів лугів з кислотами У дві пробірки наливаємо по 1 мл NaOH і по одній-дві краплі фенолфталеїну. Потім в одну з них по краплях додаємо хлоридну кислоту, у другу - сульфатну кислоту. Заносимо результати до протоколу.
Лабораторна робота № 5. Взаємодія нерозчинних основ з кислотами Нам необхідно одержати купрум(II) гідроксид. Як це зробити? Яку властивість основ для цього можна використати? CuSO4+2NaO → Cu(OH)2↓+Na2SO4 До одержаного осаду по краплях додаємо хлоридну кислоту. - Які ознаки хімічної реакції спостерігаємо? Запишіть результати досліду до протоколу. Лабораторна робота № 6. Розкладання нерозчинних основ у процесі нагрівання Нерозчинні основи за нагрівання розкладаються на оксид і воду. Перевіримо це на практиці. Одержіть купрум(II) гідроксид, закріпіть пробірку в пробіркотримачі.
Cu(OH)2→CuO+H2O Укажіть тип реакції. (Реакція розкладу) Висновок. З якими властивостями основ ми познайомилися на цьому уроці?
IV. Закріплення вивченого матеріалу Керована практика Завдання 1. Обчисліть кількість речовини води, що утвориться внаслідок нагрівання алюміній гідроксиду масою 15,6 г.
Завдання 2. Здійсніть перетворення: Cu(OH)2→CuO→CuSO4→Cu(OH)2 1) Cu(OH)2→CuO+H2O 2) CuO+H2SO4→CuSO4+H2O 3) CuSO4+2NaOH→ Cu(OH)2+2H2O
V. Домашнє завдання Опрацювати відповідний параграф підручника, виконати завдання до нього. Творче завдання. Підготувати повідомлення про використання основ. | |
| Переглядів: 675 | |
Схожі уроки:
| Всього коментарів: 0 | |